題目:以細菌β-葡萄糖醛酸酶抑制劑(TCH-3511)作為降低家族性瘜肉症罕病患者大腸癌發生及化學預防用藥
1. 解決問題
腸道葡萄醣醛酸酶(β-glucuronidase; β-G)在大腸癌生成過程中扮演著重要的角色,主要是由於肝臟的解毒機制葡萄醣醛酸化(glucuronidation)能將許多藥物或致癌劑藉由與葡萄醣醛酸(glucuronide acid)鍵結而降低毒性。然而,此類代謝物會被腸道菌所表現的β-G水解,而恢復其毒性並造成腸道損傷,長久下來將導致腸道病變及腫瘤生成,過去發現腸道菌β-G活性提高將增加罹患大腸癌的機率,而大腸癌病人糞便中的腸道菌β-G活性比正常人多達12.1倍。其中,家族性腸瘜肉症(FAP)病患因腫瘤抑制基因APC具有缺陷,腸道易受有腸道菌β-G所恢復毒性的致癌劑刺激而生成數十個到上百個腺瘤性瘜肉,且大部分容易惡化成癌症,佔大腸癌發生率的1%,而目前並沒有任何治療藥物,一旦發現有瘜肉,便將大腸切除;先前研究已經指出以抗生素降低腸道菌β-G活性可以防止腸道受損及降低大腸癌的發生,然而使用抗生素會殺死包括益生菌在內的所有原生腸道菌;利用β-G抑制劑(Saccharic acid 1,4-lactone)也被指出能防止致癌劑(DMH)引起的大腸癌發生,但Saccharic acid 1,4-lactone也會抑制人類的β-G (hβ-G)的活性,可能引起黏多醣症的發生。另外,FDA雖通過將COX-2抑制劑(Celecoxib、Sulindac)做為佐劑給術後大腸癌病人使用,但因臨床試驗中發現具有高心臟毒性,只建議高危險群使用。因此,若是能有效專一性抑制腸道菌β-G且不影響人類β-G,將可降低藥物或致癌劑的再活化,進而保護腸道避免損傷及預防大腸癌的發生。
2. 策略
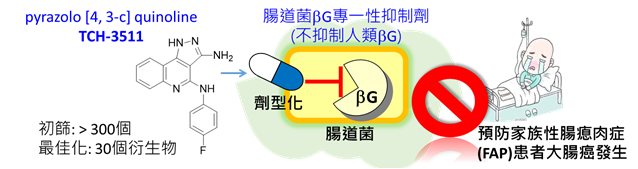
我們開發了腸道菌β-G專一性抑制劑-pyrazole [4, 3-c] quinolone衍生物TCH-3511,藉由藥物最佳化以達到穩定性佳、抑制效率佳、毒性低之腸道菌β-G抑制劑,透過大腸靶向劑型化之開發,來抑制腸道菌β-G活性,避免化療藥或致癌劑在腸道恢復毒性,而保護腸道避免化療或致癌劑誘發腸道損傷及大腸癌生成 (圖一)。
3. 產業應用性
家族性腸瘜肉症(FAP)病患因腫瘤抑制基因APC具有缺陷,腸道易受有腸道菌葡萄醣醛酸酶(β-G)所恢復毒性的致癌劑刺激而生成數十個到上百個腺瘤性瘜肉,且易惡化成癌症,而目前並沒有任何治療藥物,一旦發現有瘜肉,便將大腸切除,因此,若是有效抑制腸道菌β-G將可降低藥物或致癌劑的再活化,而保護腸道避免損傷,降低FAP患者腸瘜肉之生成,以達到預防大腸癌的發生。本技術若發展成功將有以下貢獻:
臨床效益:(1) 做為家族性瘜肉症治療用藥,延緩FAP病人腸瘜肉生成及大腸癌發生。(2) 做為預防大腸癌藥物來避免化學誘發腸道病變及大腸癌發生。(3) 作為化療佐劑以預防化療誘發腸道損傷。
產業效益:我們已於2018年獲得台灣專利(證書號:I614251),於2019年獲得歐洲專利(證書號:3302060)及日本專利(證書號:6607962),另外也已申請美國、中國專利,進行全球專利佈局。若成功將腸道菌β-G專一性抑制劑TCH-3511開發作為FAP用藥,我們將技轉國內外生技公司、藥廠,期望能將之推至臨床試驗,加速開發TCH-3511往新藥發展,將有開發潛力及龐大的商機。
4. 目前成果
目前我們篩選發現pyrazolo [4, 3-c] quinoline此類化合物可專一性抑制E. coli β-G蛋白酶活性,經由結構最佳化而合成相關30個相關衍生物,並篩選出TCH-3511。在動物實驗中,連續五天餵食小鼠TCH-3511 (3 mg/kg/day)可明顯抑制腸內90%的β-G活性;餵食TCH-3511合併化療藥物CPT-11使用可舒緩CPT-11所誘發之腹瀉,而不影響其抗癌療效(J. Med. Chem. 2017)。此外,我們初步分析發現,以TCH-3511餵食APCMin/+ (腸腺瘤好發性小鼠模式)可有效降低致癌劑DMH誘發所產生腸道瘜肉數目;並發現TCH-3511能夠改善由致癌劑AOM惡化之小鼠腸道菌多樣性及菌相整體組成。目前此腸道菌eβ-G專一性抑制劑已於2018年獲得台灣專利(證書號:I614251),於2019年獲得歐洲專利(證書號:3302060)及日本專利(證書號:6607962),另外也已申請美國、中國專利,進行全球專利佈局。
