穿透血腦障壁(Blood–Brain Barrier/BBB)抗體
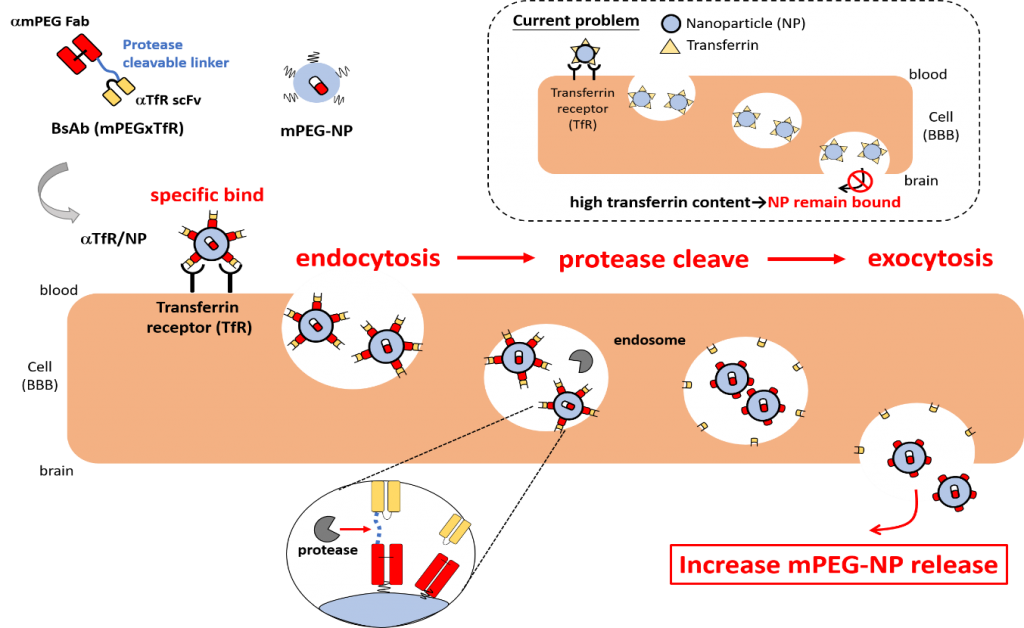
老化是神經退化性疾病的重要危險因子,其中阿茲海默症和帕金森氏症均是最常見的神經退化性疾病。然而,由於腦內有腦血管障壁(Blood-brain-barrier; BBB)造成藥物不易送入腦內疾病區域,在治療腦神經疾病方面無法找到根治的方法。目前諸多研究利用載體結合受體(如運鐵蛋白受器Transferrin receptor; TfR)介導胞移作用(Receptor-mediated transcytosis; RMT)運送藥物通過BBB,不過RMT後由於載體結合受體的親和力太高,導致載體與受體不易分離而造成藥物釋放於腦內的量相當低。為了增加藥物釋放,我們利用可被蛋白酶(serine蛋白酶)切斷之受質胜肽,將其連結在雙專一性抗體上。此雙專一性抗體一端為anti-Transferrin receptor scFv,一端可結合藥物載體上的甲氧基聚乙二醇(mPEG)的Fab抗體,建構成雙專一性抗體(BsAbs: mPEGxTfR)。mPEGxTfR的anti-mPEG 端能夠非共價結合各種mPEG-Nanoparticles(mPEG-NPs) 的甲氧基末端,並提供mPEG-NPs結合TfR的專一性,在結合受體TfR後會進行內吞作用,於初級內體(early endosome)中受質胜肽將被蛋白酶切斷並釋放mPEG-NPs,並於胞吐作用後將mPEG-NPS釋放至腦內。我們組有以下規劃目標:(1)生產可被蛋白酶切割之雙功能抗體(mPEGxmTfR)並生成雙專一性抗體修飾之微脂體製劑(amTfR/NP),(2)評估amTfR/NP胞移能力以及mPEG-NP被釋放之能力,(3)於老鼠內評估amTfR/NP之運送能力以及藥物療效,(4)生產可辨識人類TfR且被蛋白酶切割之雙專一性抗體(mPEGxhTfR)並生成雙專一性抗體修飾之微脂體製劑(ahTfR/NP),並進一步評估其胞移能力以及mPEG-NP被釋放之能力。這個策略的成功將藉由增加藥物載體通過BBB後提高釋放量,克服藥物無法有效運送到腦部的困境。
