1. 解決問題
甲氧基聚乙二醇(mPEG)修飾之奈米藥物(PEG-NPs,如:微脂體、微胞…)已被譽為是未來第三代的新藥。雖然高劑量PEG-NPs所帶來好的治療效果,但其副作用相對非常高,因此利用化學方式將抗體修飾於PEG-NPs能夠增進其腫瘤專一性;然而,化學修飾法常造成修飾上抗體的PEG-NPs有異質性(抗體修飾數目、方向不一)產生,限制了其臨床應用性。
2. 策略
我們創新的開發出雙功能抗體,將anti-tumor marker scFv 抗體結合在人類化anti-mPEG Fab抗體的C 端,建構成可同時辨認聚乙二醇分子(PEG)與各種腫瘤抗原之雙功能抗體 (BsAbs)。此抗體的anti-PEG端能夠非共價結合各種PEG-NPs的甲氧基末端,以克服化學修飾之異質性問題,並同時提供PEG-NPs 獲得結合腫瘤的專一性,以追蹤腫瘤抗原(HER2, EGFR, CD20…)過度表現癌細胞 (圖一)。
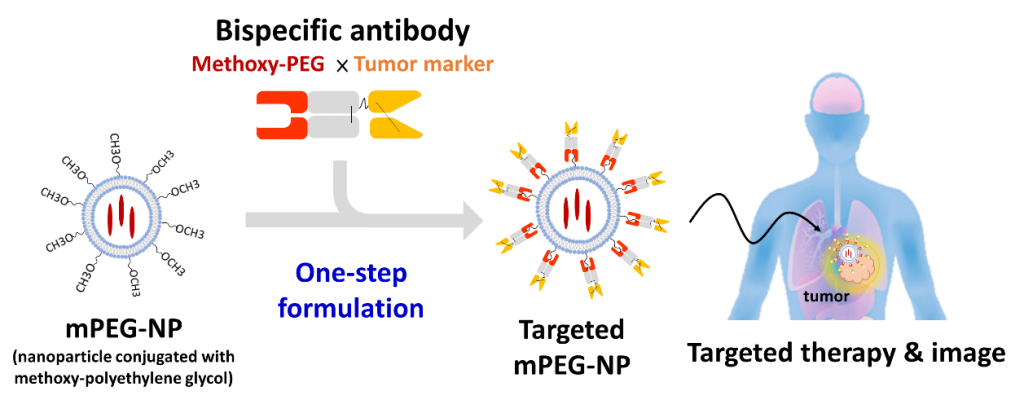
3. 產業應用性
本技術之成功,相信將能夠提供一套創新簡易且單一步驟的非共價鍵修飾法,以修飾任何PEG-NPs,期望未來能有效提升目前臨床上各式PEG-NPs,對腫瘤專一性之結合,以增進腫瘤專一性治療之功用(圖二),在未來也與國際PEG-NPs藥廠簽屬非專屬授權,將我們的雙功能抗體應用在臨床上。
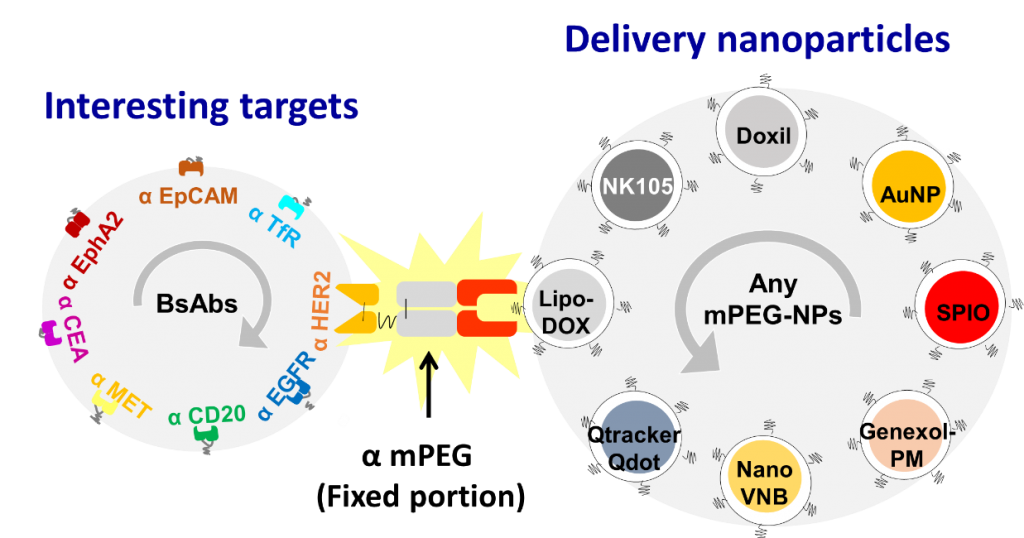
4. 目前成果
目前此平台已經成功建立多種anti-PEG雙功能抗體,來辨認不同的生物標記(ex : EGFR, HER2, CD20…,共6種,持續增加中),並且在實體腫瘤(大腸癌、乳癌、卵巢癌、胃癌…)和血液腫瘤(淋巴癌)中都驗證其療效。經由實驗證實雙功能抗體可經由one-step一步直接修飾在PEG-NP上,賦予奈米有腫瘤專一性,並且增加奈米粒子內吞到細胞中,增加藥物20到200倍以上的細胞毒殺效果,並且在活體中證實可增加2到3倍左右的藥物腫瘤累積量(圖A),最後可以有效的抑制種腫瘤生長(圖B)。目前已取得8國家專利(台灣、美國、歐盟、中國…),進行全球專利布局。
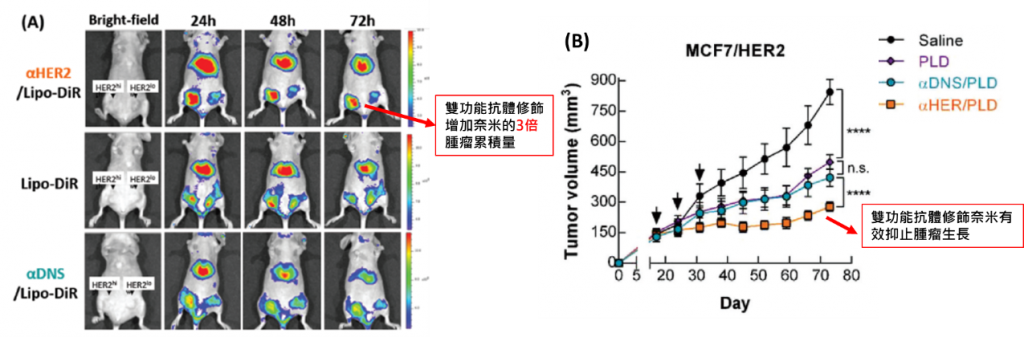
5. 相關發表論文:
1. Kao, Chien-Han, et al. “One-step mixing with humanized anti-mPEG bispecific antibody enhances tumor accumulation and therapeutic efficacy of mPEGylated nanoparticles.” Biomaterials 35.37 (2014): 9930-9940.
2. Cheng, Yi-An, et al. “Enhanced drug internalization and therapeutic efficacy of PEGylated nanoparticles by one-step formulation with anti-mPEG bispecific antibody in intrinsic drug-resistant breast cancer.” Biomaterials science 7.8 (2019): 3404-3417.
3. Chen, I-Ju, et al. “Bispecific Antibody (HER2× mPEG) Enhances Anti-Cancer Effects by Precise Targeting and Accumulation of mPEGylated Liposomes.” Acta Biomaterialia (2020).
4. Cheng, YA., Wu, TH., Wang, YM. et al. “Humanized bispecific antibody (mPEG × HER2) rapidly confers PEGylated nanoparticles tumor specificity for multimodality imaging in breast cancer.” J Nanobiotechnol 18, 118 (2020).
5. Ho, Kai-Wen, et al. “Double attack strategy for leukemia using a pre-targeting bispecific antibody (CD20 Ab× mPEG scFv) and actively attracting PEGylated liposomal doxorubicin to enhance anti-tumor activity.” J Nanobiotechnol (2020).
